

ირმა ლაგვილავა
ასევე იხილეთ
გაფართოებული ძებნა
"ქიმიის უწყებანი" ტომი:1, ნომერი:1, 63-68 გვ.
ლუმინესცენციის ფენომენი
ასისტენტ პროფესორი, საწართველოს ტექნიკური უნივერსიტეტი
რეზიუმე: რა არის ლუმინესცენცია და როგორი ნაერთები ლუმინესცენცირებენ? როგორია ლუმინოფორული ნაერთების სტრუქტურული თავისებურებები და რა კანონზომიერებებია დაკავშირებული სხვადასხვა ნაერთის ფლუორესცენციულ თვისებასთან? ეს მოვლენა დღეისათვის მეცნიერების ინტენსიური კვლევის საგანს წარმოადგენს.
საკვანძო სიტყვები: ლუმინესწენცია, ფლუორესცენცია, აზომეთინები, ფლუოროფორი, სტოქსის წანაცვლება
ლუმინესცენცია, ეს არის ნივთიერების ნათება, რომელიც წარმოიქმნება ნივთიერების მიერ აღმგზნები ენერგიის შთანთქმის შემდეგ. მოცემულ ტემპერატურაზე სხეულის სითბურ გამოსხივებასთან შედარებით წარმოადგენს ჭარბ გამოსხივებას. ლუმინესცენციის ხანგრძლივობა (10-1 0 წმ-დან რამოდენიმე საათამდე) აღემატება სინათლის რხევის პერიოდს. ლუმინესცენცია შეინიშნება ხილულ, უი და იწ უბნებში, ხანმოკლე ლუმინესცენციას, რომლის ჩახშობაც ხდება აღგზნების შეწყვეტისთანავე ე.წ. ფლუორესცენცია, ხოლო შედარებით ხანგრძლივ ლუმინესცენციას, რომელიც გრძელდება გარკვეული დროის განმავლობაში აღგზნების შემდეგ - ფოსფორესცენციას უწოდებენ. დროებითი ზღვარის გავლება ლუმინესცენციის ამ სახეებს შორის ზუსტად შეუძლებელია.
ნივთიერებებს, რომელთაც აქვთ ლუმინესცირების უნარი, სხვადასხვა სახის აღმგზნები ენერგიის ზემოქმედების შედეგად, უწოდებენ ლუმინოფორებს. ცნობილია ლუმინოფორების ორი ტიპი: ორგანული (ორგანოლუმინოფორები) და არაორგანული (კრისტალოფოსფორები) ლუმინოფორები. კრისტალოფოსფორების ლუმინესცენციას განსაზღვრავს მათი კრისტალური მესრის აღნაგობის თავისებურებები, რომელთა რღვევა იწვევს ლუმინესცენციის შეცვლას ან გაქრობას. ორგანოლუმინოფორების ლუმინესცენციაზე პასუხისმგებელია ინდივიდუალური მოლეკულის სტრუქტურა. ამიტომ ნივთიერების გადაყვანა მყარი კრისტალური მდგომარეობიდან ნალღობში ან ორთქლში, უმეტეს შემთხვევაში არ იწვევს ლუმინესცენციის გაქრობას.
ლუმინოფორის მნიშვნელოვან მახასიათებელს წარმოადგენს აღგზნებული მდგომარეობის გამოსხივების დრო, ე.ი. ის დრო, რომლის განმავლობაში გრძელდება სინათლის გამოსხივება აღმგზნები წყაროს მოცილების შემდეგ. ამ მნიშვნელობების მიხედვით ანსხვავებენ ფლუორესცენციას (გამოსხივების დრო - 10-9-10-7 წმ) და ფოსფორესცენციას (გამოსხივების დრო 10-4-10-2 წმ).
ფლუორესცენციის მოვლენა შეიძლება გამოვსახოთ იაბლონსკის დიაგრამის მიხედვით. ფლუორესცენციული საღებრის მიერ გარკვეული ენერგიის ფოტონის შთანთქმა (hν აღგზ) იწვევს მის გადაყვანას ძირითადი მდგომარეობიდან S0 აღგზნებულ სინგლეტურ მდგომარეობაში S1'. მოლეკულა აღგზნებულ მდგომარეობაში რჩება მხოლოდ 1-10 ნწმ-ის განმავლობაში. ამ პერიოდში ადგილი აქვს კონფორმაციულ ცვლილებებსა და ურთიერთქმედებებს მოლეკულურ გარემოსთან: შეჯახებით ჩახშობას, ფლუორესცენციული ენერგიის გადატანას და სხვა. ამის შედეგად ენერგია S1' ნაწილობრივ იხარჯება და წარმოიქმნება რელაქსაციური სინგლეტური აღგზნებული მდგომარეობა S1, რომელიც საწყის მდგომარეობაში S0 დაბრუნებისას გამოანთავისუფლებს ენერგიას hνგამ ფლუორესცენციული გამოსხივებით.
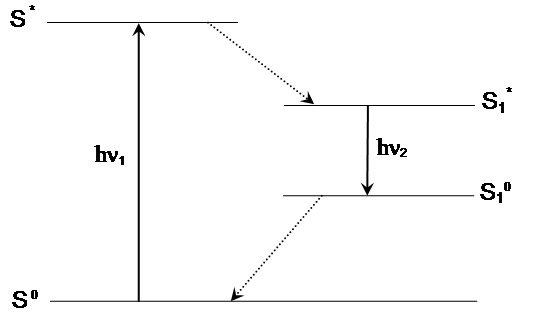
იაბლონსკის დიაგრამა
დღეისათვის ცნობილია მრავალი ორგანული ნაერთი, რომლებიც ანათებენ - ლუმინესცენცირებენ გამააქტივებელი გამოსხივების ზემოქმედების შედეგად. აღმგზნები ენერგიის სახეების მიხედვით განასხვავებენ ლუმინესცენციის სხვადასხვა სახეს.
1. ფოტოლუმინესცენცია - უი სხივებით აღგზნება
2. რადიოლუმინესცენცია - რადიოაქტიური გამოსხივებით აღგზნება
3. კათოდური და რენტგენოლუმინესცენცია- კათოდური და რენტგენური სხივებიით აღგზნება
4. ელექტროლუმინესცენცია - ელექტროქიმიური რეაქციით გამოწვეული აღგზნება
5. ტრიბოლუმინესცენცია - ხახუნით გამოწვეული აღგზნება
6. ქემილუმინესცენცია - ქიმიური რეაქციით გამოწვეული აღგზნება
ძალიან ხშირად, ერთი და იგივე ორგანოლუმინოფორის აღგზნება შესაძლებელია სხვადასხვა სახის ენერგიით. მაგალითად, ფოტოლუმინოფორები ზოგჯერ აქტიურდებიან მაიონიზირებელი გამოსხივების ზემოქმედების შედეგად და ამიტომ გამოყენებას პოულობენ სცინტილატორების სახითაც.
ლუმინესცენციური ნივთიერებების მახასიათებლებს, რომლებიც განსაზღვრავენ მათი, როგორც ორგანული ლუმინოფორების გამოყენების შესაძლებლობებს, წარმოადგენს:
1. ელექტრონული სპექტრი
2. კვანტური გამოსავლიანობა
3. ნათების ხანგრძლივობა
ლუმინესცენციური ნივთიერებების ელექტრონული სპექტრები განპირობებულია ენერგეტიკული (ელექტრონული) გადასვლებით მოლეკულის არააღგზნებულ (ძირითადი) და აღგზნებულ მდგომარეობებს შორის. ძირითადი მდგომარეობიდან აღგზნებულ მდგომარეობაში გადასვლა ხასიათდება შთანთქმის სპექტრით, ხოლო აღგზნებულიდან ძირითადში - გამოსხივების სპექტრით (ლუმინესცენციით).
შთანთქმის სპექტრი საშუალებას იძლევა ვიმსჯელოთ გადასვლის ენერგიაზე ძირითადი მდგომარეობიდან აღგზნებული მდგომარეობის სხვადასხვა დონეზე და ქვე-დონეზე. ლუმინესცენციის (გამოსხივების) სპექტრი კი პირიქით, ახასიათებს გადასვლის ენერგიებს აღგზნებული მდგომარეობის ყველაზე დაბალი დონიდან ძირითადი მდგომარეობის სხვადასხვა ქვედონეზე.
გარდა მთავარი დონეებისა, მოლეკულის ენერგეტიკული მდგომარეობა განისაზღვრება ასევე ქვედონეების ნაკრებით, რომელიც დაკავშირებულია მოლეკულების რხევით და ბრუნვით მოძრაობებთან.
ხშირად ლიტერატურაში, ორგანული ნაერთების სპექტრალურ-ლუმინესცენტურ თვისებებზე მიძღვნილ შრომებში შეხვდებით ტერმინს „0-0 ზოლი“. იგი ახასიათებს ენერგიების გადასვლას მთავარ (ყველაზე დაბალ) დონეებს შორის.
გამოსხივების სიხშირე ყოველთვის ნაკლებია ან ტოლია შთანთქმული სინათლის სიხშირისა (სტოქსის კანონი). ამიტომ ლუმინესცენციის სპექტრი ჩვეულებრივ მდებარეობს უფრო გრძელტალღოვან უბანში, ვიდრე შთანთქმის სპექტრი.
ცნობილია ისეთი შემთხვევებიც, როცა სინათლის კვანტის შთანთქმის შემდეგ, მოლეკულა აღგზნებულ მდგომარეობაში განიცდის სტრუქტურულ ცვლილებებს (იცვლება კუთხეები და ატომთა შორის მანძილები), რომლებიც ელექტრონული სიმკვრივის ახლებურ განაწილებას იწვევს და მოლეკულა აღმოჩნდება უფრო დაბალ აღგზნებულ დონეზე. სინათლის გამოსხივების შემდეგ იგი იცვლება საპირისპირო მიმართულებით. ასეთ დროს სტოქსის წანაცვლების მნიშვნელობა იზრდება 150-200 ნანომეტრამდე.
ლუმინოფორული ნაერთის სიკაშკაშე (სიძლიერე) დამოკიდებულია მთელ რიგ ფაქტორებზე. მათ შორის აღსანიშნავია აღგზნების წყაროს სიმძლავრე და შთანთქმის ინტენსიურობა. რაც უფრო სინათლის მეტ კვანტს შთანთქავს მოლეკულა, მით მეტი კვანტი გამოსხივდება.
ლუმინესცენციის ინტენსიურობის განმსაზღვრელ მნიშვნელოვან ფაქტორს წარმოადგენს კვანტური გამოსავლიანობა. იგი ლუმინოფორის სასარგებლო მოქმედების ერთგვარ კოეფიციენტს წარმოადგენს. კვანტური გამოსავლიანობა არის გამოსხივებული და შთანთქმული კვანტების რაოდენობის ფარდობა.
აბსოლუტური კვანტური გამოსავლიანობა დამოკიდებული არ არის აღგზნების წყაროს სიმძლავრეზე და შთანთქმის ინტენსიურობის მსგავსად, განისაზღვრება მოლეკულის აღნაგობით. თუ ადგილი არ აქვს გამოსხივების გარეშე ენერგიის დეგრადაციას, მაშინ გამოსხივებული კვანტების რიცხვი შეიძლება შთანთქმული კვანტების რიცხვის ტოლი იყოს.
თავის მხრივ ელექტრონული გადასვლების ხასიათი განისაზღვრება მოლეკულის სტრუქტურის თავისებურებით.
დღეისათვის არ არის საკმარისი ის სისტემატიზირებული მონაცემები, რომელიც მოგვცემს უფლებას დამაჯერებლად ჩამოვაყალიბოთ წესები, რომელიც დააკავშირებს მოლეკულის აღნაგობას და ფლუორესცენციულ თვისებებს. არადა მათ დიდი პრაქტიკული მნიშვნელობა ექნებოდათ, რამდენადაც მოგვცემდნენ ლუმინოფორების მიზანმიმართული სინთეზის განხორციელების საშუალებას და თავს ავარიდებდით ემპირიულ მიდგომას.
სანამ დავიწყებდეთ მსჯელობას მოლეკულის აღნაგობასა და ლუმინესცენციას შორის დამოკიდებულებაზე, პირველ რიგში ყურადღება მივაქციოთ სტრუქტურულ ფრაგენტებს, რომლებიც იწვევენ ლუმინესცენციის მოვლენას და მისი ინტენსიურობის გაზრდას. მარტივ მაგალითებზე განვიხილოთ ამ ჯგუფების გავლენა ნათების ფერზე.
ფაქტორებს, რომლებიც ხელს უწყობენ ლუმინესცენციის წარმოქმნას და მათ გადანაცვლებას გრძელტალღოვან უბანში, პირველ რიგში უნდა მივაკუთვნოთ შეუღლებული სისტემის დაგრძელება. უკვე მარტივი არომატული ნახშირწყალბადების რიგში ბენზოლის ბირთვის რაოდენობის ზრდით და ამასთანავე σσ*- დონის ენერგიის შემცირებით შეიმჩნევა ნათების ინტენსიურობის ზრდა და ერთდროულად ბატოქრომული წანაცვლება ნ-ჰექსილ)პოლიფენილენის რიგში.
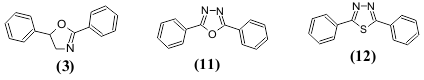
ასეთივე დამოკიდებულება შეიძლება შევნიშნოთ აგრეთვე სხვა შეუღლებულ სისტემაზე. მაგალითად: 2-მეთილ-5-ფენილოქსაზოლს (2) ახასიათებს სუსტი ლუმინესცენცია, ხოლო 2,5-დიფენილოქსაზოლს (3), რომელიც მოიცავს უფრო გრძელ შეუღლებულ სისტემას, ახასიათებს ინტენსიური ნათება, როგორც კრისტალურ მდგომარეობაში, ასევე ხსნარებში.
როგორც ჩანს, დამატებითი არომატული ბირთვის წარმოქმნას შეუღლებული ჯაჭვის ბოლოს, მივყავართ ლუმინესცენციის მაქსიმუმის მნიშვნელოვან წანაცვლებამდე გრძელტალღოვანი უბნისაკენ. შეუღლებული ჯაჭვის ზრდასთან ერთად იზრდება ნათების ინტენსიურობა.
აქვე უნდა აღინიშნოს, რომ ქვანტური გამოსავლიანობა შეუღლებული ჯაჭვის ზრდასთან ერთად ყოველთვის არ იზრდება მოლეკულის სტრუქტურის გართულებასთან ერთად, განსაკუთრებით გრძელი ჯაჭვის მქონე ნაერთებში, იმავდროულად იზრდება ენერგიის დანაკარგი გამოსხივების გარეშე. იგი დაკავშირებულია შიდამოლეკულურ ბრუნვებთან და რხევებთან. ეს უკანასკნელი უარყოფით გავლენას ახდენს გამოსხივების ინტენსიურობაზე. ქვანტური გამოსავლიანობის ზრდა ხდება მხოლოდ ჯაჭვის გარკვეულ სიგრძემდე. შემდგომი გაგრძელება კი პირიქით, მის შემცირებას გამოიწვევს, რაც ხშირად შეიმჩნევა შთანთქმის სპექტრების გრძელტალღოვან უბანში გადანაცვლებისას და ფლუორესცენციის დროს.
ლუმინესცენციის ინტენსიურობა არამარტო შეუღლებული ჯაჭვის სიგრძეზე, არამედ ელემენტების სტრუქტურულ ბუნებაზეც არის დამოკიდებული. მაგალითად: ფლუორესცირებადი 1,4-დიფენილ-1,3-ბუტადიენის (4) აზოტშემცველ ანალოგს დიბენზილაზინს (5) არ გააჩნია ფლუორესცენტული თვისება, როგორც კრისტალურ ფორმაში, ისევე ხსნარებში, არც ოთახის ტემპერატურაზე და არც გაყინულ მდგომარეობაში.
ლუმინესცენციის არსებობისათვის გრძელ შეუღლებულ სისტემასთან ერთად საჭიროა მოლეკულაში სხვადასხვა სტრუქტურული ფაქტორების არსებობაც. უპირველეს ყოვლისა მოლეკულა უნდა იყოს ხისტი (უხეში) სტრუქტურის, რათა შემცირდეს შთანთქმული ენერგიის დაკარგვა და გაიზარდოს გამოსხივების გარეშე რადიაციული გადასვლების ალბათობა. ასეთი ხისტი სტრუქტურა შეიძლება მიღებულ იქნას ახალი ციკლების წარმოქმნისა და შიდამოლეკულური წყალბადური ბმების წარმოქმნის შედეგად. აღნიშნულის სადემონსტრაციოდ შეიძლება მოვიყვანოთ 2-ფენილბენზიმიდაზოლი (8) იგი N-ბენზალანილინისაგან (9) განსხვავებით ავლენს ფლუორესცენციის უნარს.
N,N'-დისალიცილალაზინი (10), რომელიც განსხვავდება დიბენზალაზინისაგან (5) შიდამოლეკულური წყალბადური ბმების არსებობით, გააჩნია ფლუორესცენცია როგორც კრისტალურ ფორმაში ისე გაყინული ხსნარების სახითაც.
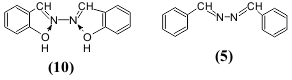
ლუმინესცენციურ თვისებაზე ასევე გავლენას ახდენს შეუღლებულ სისტემაში ჩართული ჰეტეროციკლის ჰეტეროატომების ბუნება და რიცხვი. 2,5-დიფენილოქსაზოლი (3) ფლუორესცირებს უფრო გრძელტალღოვან უბანში და ინტენსიურად, ვიდრე 2,5-დიფენილ-1,3,4-ოქსადიაზოლი (11), მაშინ როდესაც 2,5-დიფენილ-1,3,4-თიადიაზოლს (12) ახასიათებს მხოლოდ სუსტი ნათება.
გარდა შეუღლებული ჯაჭვის სიგრძისა, შთანთქმის ინტენსიურობაზე და ფერის ნათებაზე გავლენას ახდენს მოლეკულის სივრცითი აღნაგობა, რომელზეც არის დამოკიდებული σ-ელექტრონების გადანაცვლების ეფექტურობა: გადანაცვლება შესაძლებელია, როცა შეუღლებული სტრუქტურული ფრაგმენტები მდებარეობენ ერთ სიბრტყეში. საილუსტრაციოდ შეიძლება მოვიყვანოთ ნაერთი 13 და 14:
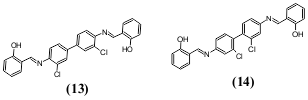
ნაერთი 14-ის ქლორის ატომები 2,2'-მდებარეობაში მოლეკულას ხდიან არაბრტყელს, აძნელებენ ბირთვებს შორის შეუღლებას. ამის შედეგია ჰიპსოფლორული წანაცვლება და ფლუორესცენციის ინტენსიურობის მკვეთრი შემცირება.
ნათების ფერზე და სიკაშკაშეზე დიდ გავლენას ახდენს ასევე ჩამნაცვლებლები არომატულ და ჰეტეროციკლურ ფრაგმენტებში. როგორც ცნობილია, შეუღლებულ ჯაჭვში ჩართული ელექტრონოდონორული და ელექტრონოაქცეპტორული ჩამნაცვლებლები იწვევენ p-ელექტრონების გადანაცვლებას, რომელიც არ არის დამოკიდებული სინათლის ზემოქმედებაზე. ამის შედეგად მცირდება სხვაობა ძირითად და აღგზნებულ მდგომარეობებს შორის და შესაბამისად ხდება შთანთქმის წანაცვლება და ფლუორესცენციის გადანაცვლება გრძელტალღოვანი უბნისაკენ. ამასთანავე უფრო დიდი ეფექტი მიიღწევა ელექტრონოდონორული და ელექტრონოაქცეპტორული ჩამნაცვლებლების შეთანხმებული მოქმედებისას. ფლუორესცენციის წანაცვლებას გრძელტალღოვანი უბნისაკენ ხშირად (მაგრამ ყოველთვის არა) მოსდევს ქვანტური გამოსავლიანობის ზრდა. ჩამნაცვლებლების ასეთი გავლენის მაგალითად შეიძლება მოვიყვანოთ ჩანაცვლებული 2,5-დიფენილოქსაზოლები (R=N(CH3)2SO2CHF2) (16), რომელიც შეიცავს ძლიერ ელექტრონოდონორულ ან ძლიერ ელექტრონოაქცეპტორულ ჩამნაცვლებლებს.
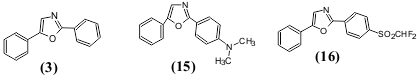
N,N-დიმეთილამინოჯგუფის შეყვანისას ფლუორესცენციის მაქსიმუმის წანაცვლება ტოლუოლის ხსნარში ხდება ბატოფლორულად 35 ნმ-ით, ხოლო ქვანტური გამოსავალი იზრდება 0.5-დან 0.6-მდე. დიფთორმეთილსულფონური ჯგუფი ფლუორესცენციის მაქსიმუმს გადაანაცვლებს გრძელტალღოვანი უბნისაკენ 40 ნმ-ით და ზრდის ქვანტურ გამოსავლიანობას 0.8-მდე.
პირიქით ელექტრონოდონორული ჩამნაცვლებლების შეყვანისას ფენილაზოლურ ფრაგმენტში ქვანტური გამოსავლისანობა არათუ არ მცირდება, არამედ ზოგიერთ ნაერთში იზრდება კიდეც. ამ შემთხვევაში მცირდება მოლეკულების პოლარიზაცია პირველ აგზნებულ მდგომარეობაში. ისინი იძენენ უფრო ხისტ სტრუქტურას და მცირდება ელექტრონული აღგზნების არაგამოსხ[ივებადი დეგრადაციის ალბათობა.
ჩამნაცვლებლების შეთან[მებული გავლენის მაგალითად შეიძლება გამოვიყვანოთ ნაერთი (17) 4-ტრიფთორმეთილსულფონილ-N-ბენზალანილინი, რომელიც
შეუღლებული ჯაჭვის ბოლოებში შეიცავს ძლიერ ელექტრონოდონორულ და ძლიერ ელექტრონოაქცეპტორულ ჩამნაცვლებლებს. იგი საკმაოდ ინტენსიურად ანათებს ხსნარებში ოთახის ტემპერატურაზე იმ ნაერთებისაგან განსხვავებით, რომელიც შეიცავს ამ ჩამნაცვლებლებისაგან ერთ-ერთს.
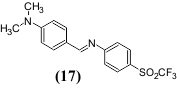
განსაკუთრებულ ინტერესს იწვევს ნიტროჯგუფი, როგორც ჩამნაცვლებელი. იგი შეიძლება ჩაითვალოს ფლუორესცენციის ჩამხშობად. არომატული ნახშირწყალბადები და მათი ჰეტეროციკლური ანალოგები, რომელთაც შედარებით მოკლე შეუღლებული p-სისტემა გააჩნიათ, ნიტროჯგუფის შეყვანით ლუმინესცენციურ თვისებებს კარგავენ. თუმცა ამავე დროს ცნობილია მრავალი ნივთიერება, რომელიც შეიცავს ნიტროჯგუფს და ინტენსიურად ანათებს. ჩვეულებრივ ეს ლუმინოფორები მოყვითალო ან მწვანე ფერისაა და აქვთ გრძელტალღოვანი ნათება.
იმ კანონზომიერების განხილვისას, რომლებიც დაკავშირებულია სხვადასხვა ნაერთების ფლუორესცენციულ თვისებებზე ნიტროჯგუფის გავლენაზე ლიპერტი მივიდა დასკვნამდე, რომ როცა გრძელტალღოვანი შთანთქმის ზოლის შესაბამისი ელექტრონული გადასვლის ენერგია მეტია R-NO2 ბმის ენერგიაზე, ფლუორესცენცია არ შეიმჩნევა.
აქედან გამომდინარეობს ემპირიული წესი: ნიტრო]გუფის შემცველი ნაერთები, რომელთა გრძელტალღოვანი შთანთქმის ზოლის მაქსიმუმი განლაგებულია 500ნმ-ზე ნაკლებ ტალღის სიგრძეზე, არ ფლუორესცენცირებენ.
4-ნიტროსტილბენი (18) არალუმინესცენციური ნაერთია, ხოლო მონონიტროჩანაცვლებული დისტირილბენზოლი (19) საკმაოდ ინტენსიურად ანათებს, როგორც ხსნარებში ისე კრისტალების სახით.
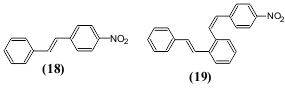
ზოგჯერ ჩამქრობ ეფექტს ადგილი აქვს ჰალოგენის შეყვანისას. ჰალოგენის რიგობრივი ნომრის ამაღლება ამცირებს ნათების ინტენსიურობას (იოდი მას მთლიანად აქრობს). ამავე დროს ცნობილია არც თუ ისე დიდი რაოდენობა მაგალითებისა, როცა ჰალოგენები ამაღლებენ ნათების ინტენსიურობას (სიკაშკაშე). ასეთი ნაერთების რიცხვს შეიძლება მივაკუთვნოთ უკვე ნახსენები 3,3'-დიქლორ-N.N'-დისალიცილალბენზიდინი (13), რომელიც ანათებს გაყინულ დიმეთილფორმამიდის ხსნარებში უფრო ინტენსიურად, ვიდრე არაქლორშემცველი N,N'-დისალიცილბენზიდინი (20).
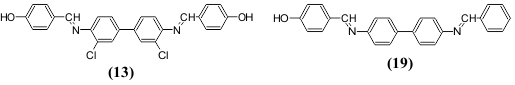
ფლუორესცენციის მაქსიმუმების მდებარეობაზე ჰალოგენის შეყვანა, ჩვეულებრივ არსებით გავლენას არ ახდენს.
დასასრულს მინდა ავღნიშნო, რომ საღებრები რომლებიც ხასიათდებიან ფლუორესცენციის უნარით დიდი გამოყენება ჰპოვეს როგორც უხილავი მარკერები ფულის კუპიურების, აქციზური მარკებისა და სხვა მასალებისათვის, საკანცელარიო და განსაკუთრებით ჭავლური პრინტერების ფერადი მელნების წარმოებაში. ორგანულ ლუმინოფორებს ასევე დიდი გამოყენება აქვთ მიკრობიოლოგიასა და ქიმიაში.
გამოქვეყნებულია: 06-07-2013