| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

მოვერსცლისფერო–თეთრი მეტალი
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
როდიუმი, Rh, 45 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
9, 5, d |
| ატომური მასა |
102.90550 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
5s1 4d8 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 16, 1 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
12.41 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
10.7 გ სმ-3 |
| ლღობის ტემპერატურა |
2237 K, 1964 ˚C |
| დუღილის ტემპერატურა |
3968 K, 3695 ˚C, 6683 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
26.59 კჯ მოლი-1 |
| აორთქლების სითბო |
494 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
6, 5, 4, 3, 2, 1, -1 |
| ელექტროუარყოფითობა |
2.28 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 719.7 კჯ·მოლ−1 |
| ატომური რადიუსი |
134 pm |
| კოვანელტური რადიუსი |
142 pm |
| ვან დერ ვაალსის რადიუსი |
pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
წახნაგცენტრირებული კუბური |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 43.3ნΏ მ |
| სითბოგამტარობა |
(300 K) 150 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 8.2 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 4700მ/წმ |
| იუნგის მოდული |
380 გპა |
| შერის მოდული |
150 გპა |
| ბულკის მოდული |
275 გპა |
| სიმტკიცე მოსის მიხედვით |
6.0 |
| CAS-ის რეფისტრაციის ნომერი |
7440-16-6 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 99Rh | სინთ | 16.1 d | ε | - | 99Ru |
| γ | 0.089, 0.353, 0.528 |
- | |||
| 101mRh | სინთ | 4.34 d | ε | - | 101Ru |
| IT | 0.157 | 101Rh | |||
| γ | 0.306, 0.545 | - | |||
| 101Rh | სინთ | 3.3 y | ε | - | 101Ru |
| γ | 0.127, 0.198, 0.325 |
- | |||
| 102mRh | სინთ | 2.9 y | ε | - | 102Ru |
| γ | 0.475, 0.631, 0.697, 1.046 |
- | |||
| 102Rh | სინთ | 207 d | ε | - | 102Ru |
| β+ | 0.826, 1.301 | 102Ru | |||
| β− | 1.151 | 102Pd | |||
| γ | 0.475, 0.628 | - | |||
| 103Rh | 100% | 103Rh სტაბილურია58 ნეიტრონებით | |||
| 105Rh | სინთ | 35.36 h | β− | 0.247, 0.260, 0.566 |
105Pd |
| γ | 0.306, 0.318 | - | |||
როდიუმი
როდიუმი (Rhodium) არის იშვიათი ქიმიური ელემენტი. იგი მოვერცხლისფრო-თეთრი ფერის, მაგარი ინერტული გარდამავალი მეტალია, შედის პლატინის ჯგუფში. მისი ქიმიური სიმბოლოა Rh, ხოლო ატომური ნომერია 45. ბუნებაში გავრცელებული როდიუმი შედგება მხოლოდ მხოლოდ ერთი იზოტოპისაგან - 103Rh. როდიუმი როგორც ავღნიშნეთ იშვიათი მეტალია. მისი ფასი 2010 წლისათვის დაახლოებით შეადგენს US$80.000/კგ. ის ამ კლასის წევრებს შორის ყველაზე ძვირია.
როდიუმი აღმოჩენილ იქნა 1803 წელს ვ.ჰ. ვოლასტონის მიერ. ის აღმოჩენილ იქნა პლატინის და ნიკელის საბადოებში პლატინის ჯგუფის სხვა მეტალებთან ერთად. როდიუმი ძირითადად გამოიყენება როგორც კატალიზატორი სამ-საფეხურიან კატალიზურ გარდაქმნებში. როდიუმი ინერტულია კოროზიის მიმართ, მაგრამ აგრესიულია და ამიტომაც როდიუმი გვხვდება პლატინასა და პალადიუმთან შენადნობის სახით, რომელიც გამოიყენება მარალ ტემპერატურაზე და კოროზიამედეგი შეფუთვისათვის. თეთრი ოქრო ხშირად დაფარულია როდიუმის თხელი ფენით, რაც აუმჯობესებს მის თვისებებს.
როდიუმის დეტექტორები გამოიყენება ბირთვულ რეაქტორებში ნეიტრონების ნაკადის დონის გასაზომად.
ისტორია

ვილიამ ჰაიდ ვოლესტონი
(William Hyde Wollaston)
როდიუმი (ბერძულ. rhodon ნიშნავს "ვარდს") არმოცენილ იქნა 1803 წელს ვ.ჰ. ვოლასტონის მიერ (მას შემდეგ, რაც მან აღმოაჩინა პალადიუმი). იგი ნედლეულად იყენებდა პლატინის საბადოს სამხრეთ ამერიკიდან, საბადოს ხსნიდა სამეფო წყალში და მჟავას ანეიტრალებდა ნატრიუმის ჰიდროქსიდით (NaOH). შემდგომში ამონიუმის ქლორიდის (NH4Cl) დამატებით გამოილექებოდა ამონიუმქლორპლატინატი. სხვა მეტალების უმეტესობა. მათ შორის სპილენძი, ტყვია, პალადიუმი და როდიუმი ილექებოდა თუთიასთან ერთად. განზავებულ აზოტმჟავაში იხსნებოდა პალადიუმი და როდიუმი, რომელსაც შემდგომ ხსნიდნენ სამეფო წყალში და როდიუმი გამოილექებოდა ნატრიუმის ქლორიდის დამატებით Na3[RhCl6]•nH2O -ის სახით. შემდგომ ნალექს რეცხავდნენ ეთანოლით და მოვარდისფრო-წითელი ნალექი ურთიერთქმედებდა თუთიასთან, ეს უკანასკნელი იონურ ნაერთებში ჩაენაცვლებოდა როდიუმის ნაცვლად და როდიუმი გამოიყოფოდა თავისუფალი მეტალის სახით.
აღმოჩენის შემდეგ, როგორც იშვიათ ელემენტს - როდიუმს ჰქონდა უმნიშვნელო გამოყენება. მაგალითად, საუკუნის დასაწყისში როდიუმშემცველი თერმოწყვილები გამოიყენებოდა ტემპერატურის გასაზომად 1800°C-ზე ზევით. შემდგომი მისი მნიშვნელოვანი გამოყენება იყო დეკორატიული და კოროზიამედეგ საფარებად გამოყენება. ასევე გამოიყენებოდა კატალიზურ რეაქციებში.
დახასიათება
როდიუმი წარმოადგენს მოვერცხლისფრო-თეთრი ფერის მბზინავ მეტალს. იგი მაგარია და აქვს გაწელვისა და არეკვლის უნარი. როდიუმის კრისტალი წარმოადგენს წახნაგცენტრირებულ კუბს. მისი სიმკვრივეა 12.41გ/სმ3, ხოლო ლაღობის ტემპერატურაა - 1963°C. მეტალური როდიუმი წარმოქმნის ოქსიდს გაცხელების დროსაც კი. ატმოსფეროდან ჯანგბადი აბსორბირდება მხოლოდ მისი ლღობის წერტილზე, მაგრამ გამყარებისას როდიუმი თავისუფლდება მისგან. როდიუმს გააჩნია უფრო მარალი ლრობის ტემპერატურა და უფრო დაბალი სიმკვრივე ვიდრე პლატინას. იგი არ ურთიერთქმედებს უმეტეს მჟავებთან, არ იხსნება აზოტმჟავაში და ნაწილობრივ იხსნება სამეფო წყალში. როდიუმის ზოგიერთი მარილის ხსნარი ვარდისფერია. აქედან წარმოიშვა მისი სახელწოდება.
ქიმიური თვისებები
როდიუმი მდებარეობს პერიოდული სისტემის მე-9 ჯგუფში. მას სავალენტო შრეზე გააჩნია არატიპიური ელექტრონული კონფიგურაცია, რომელიც ასევე შეიმჩნევა მეზობელ ნაერთებში ნობიუმში(41), რუთენიუმში (44), როდიუმში (45) და პალადიუმში (46).
Z ელემენტი შრეებზე ელექტრონების აღნაგობა 27 კობალტი 2, 8, 15, 2 45 როდიუმი 2, 8, 18, 16, 1 77 ირიდიუმი 2, 8, 18, 32, 15, 2 109 მეითნერიუმი 2, 8, 18, 32, 32, 15, 2
| როდიუმის დაჟანგულობის რიცხვი | |
| +0 | Rh4(CO)12 |
| +1 | RhCl(PH3)2 |
| +2 | Rh2(O2CCH3)4 |
| +3 | RhCl3, Rh2O3 |
| +4 | RhF4, RhO2 |
| +5 | RhF5, Sr3LiRhO6 |
| +6 | RhF6 |
როდიუმის ჩვეულებრივი დაჟანგულობის რიცხვია +3, თუმცა აგრეთვე გვხვდება დაჟანგულობის რიცხვი 0-დან +6-მდე. რუთენიუმისა და ოსმიუმისაგან განსხვავებით როდიუმი წარმოქმნის არააქროლად ჟანგბადნაერთებს, მათ შორის ცნობილი მდგრადი ნაერთებია: Rh2O3, RhO2, RhO2•xH2O, Na2RhO3, Sr3LiRhO6 და Sr3NaRhO6. ჰალოგენნაწარმები გვხვდება თითქმის ყველა დაჟანგულობის რიცხვით. ამის მაგალითია როდიუმ (III) ქლორიდი, როდიუმ(IV) ფთორიდი, როდიუმ(V) ფთორიდი და როდიუმ(VI) ფთორიდი. დაბალი ჟანგვითი რიცხვი მდგრადია იმ შემთხვევაში, თუ შედის ლიგანდის შემადგენლობაში.
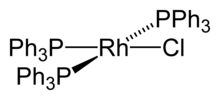
ვილკინსონის კატალიზატორი
ყველაზე ცნობილი როდიუმ ჰალოგენნაერთია ვილკინსონის კატალიზატორი - ქლოროტრის(ტრიფენილფოსფინ) როდიუმ (I). ეს კატალიზატორი გამოიყენება ალკენების ფორმილირებისა და ჰიდროგენიზაციის რეაქციებში.
იზოტოპები

როდიუმით დაფერილი თეთრი ოქროს საქორწინო ბეჭედი
ბუნებაში გავრცელებულია როდიუმის მხოლოდ ერტი სტაბილური იზოტოპი - 103Rh. ყველაზე მდგრადი რადიოიზოტოპებია 101Rh (ნახევარდაშლის პერიოდი - 3.3 წელი), 102Rh (ნახევარდაშლის პერიოდი - 207 დღე), 102მეტაRh (ნახევარდაშლის პერიოდი - 2.9 წელი) და 99Rh (ნახევარდაშლის პერიოდი - 16.1 დღე). ოც სხვა რადიოიზოტოპს აქვს ატომური წონა 92.926u (93Rh)-დან 116.925 u (117Rh)-მდე. მათი უმეტესობის ნახევარდაშლის პერიოდი ერთ საატზე ნაკლებია. გამონაკლისია 100Rh (ნახევარდაშლის პერიოდი - 20.8 საათი) და 105Rh (ნახევარდაშლის პერიოდი - 35.36 საათი). აგრეთვე არსებობს მეტა მდგომარეობა, რომელთაგან ყველაზე სტაბილურია 102მეტაRh (0.141 MeV) ნახევარდაშლის პერიოდი - 2.9 წელი და 101მეტაRh (0.157 MeV) ნახევარდაშლის პერიოდი - 4.34 დღე.
103Rh წარმოადგენს ელექტრონების შემბოჭავს და პირველად ნიმუშს b-გამოყოფის შემდეგ. პირველადი დაშლის პროდუქტი 103Rh-ის წინ არის რუთენიუმი და შემდგომი პროდუქტია პალადიუმი.
გავრცელება
დედამიწის ქერქში როდიუმი დაახლოებით არის 1 ×10-7% (მასის მიხედვით). იგი ყოველთვის გვხვდება საბადოებში შერეული სხვა მეტალებთან ერთად, როგორიცაა პალადიუმი, ვერცხლი, პლატინა და ოქრო. პლატინის საბადოებიდან მას ექსტრაგირებენ თეთრი ინერტული მეტალის სახით, რომელიც ძნელად იძლევა შენადნობებს. როდიუმის ძირიტადი წყარო არსებობს სამხრეთ აფრიკაში, ურალის მთის მდინარეების ქვიშაში და ჩრდილოეთ ამერიკაში. როდიუმის ძირიტადი ექსპორტიორია სამხრეთ აფრიკა (> 80%), შემდეგია რუსეთი. ამ ელემენტის წლიური წარმოება შეადგენს დაახლოებით 25 ტონას. 2007 წლის ოქტომბერში როდიუმი დაახლოებით რვაჯერ ძვირი იყო ოქროზე, 450-ჯერ ძვირი ვერცხლზე და 27.250-ჯერ ძვირი სპილენძზე (წონის მიხედვით). ბოლო წლებში კი მისი ფასი კიდევ უფრო გაიზარდა.
ბირთვული საწვავის გამოყენება
როდიუმი წარმოადგენს ურან-235-ის დაშლის პროდუქტს. ყოველი დაშლილი ერთი კილოგრამი პროდუქტი სეიცავს მნიშვნელოვანი რაოდენობით პლატინის ჯგუფის მეტალებს, მათ შორის როდიუმსაც. ე.ი. ბირთვული საწვავი შეიძლება გახდეს როდიუმის წყარო.
როდიუმის უპირველესი გამოყენებაა ავტომობილებში, როოგორც კატალიზური გარდამქმნელი, რომელიც ცვლის მავნე გამონაბოლქვს ნაკლებ დაჭუჭყიანებულ აირად.
2007 წელს როდიუმის მსოფლიო წარმოების 81% გამოყენებულ იქნა სამსაფეხურიან კატალიზურ გარდაქმნებში. როდიუმმა გამოამჟღავნა რამდენადმე უკეთესი თვისებები აზოტის ოქსიდების აზოტად და ჟანგბადად აღდგენის რეაქციებში, ვიდრე სხვა რომელიმე პლატინის ჯუფის მეტალებმა.
2 NOx → x O2 + N2
2007 წელს, 5.7 ტონა როდიუმი იქნა ექსტრაგირებული საბადოებიდან. როდიუმი კატალიზატორად ბევრ სამრეწველო პროცესშია გამოყენებული: მათგან განსაკუთრებით აღსანიშნავია საავტომობილო კატალიზური გარდამქმნელები და აგრეთვე მეთანოლის კატალიზური კარბონილირება ძმარმჯავის წარმოქმნის დროს მონსანტოს პროცესებში. იგი აგრეთვე გამოიყენება კატალიზატორად ჰიდროსილანების მოლეკულაში ორმაგ ბმაზე დამატების დროს. ეს პროცესაი მნიშვნელოვანია ზოგიერთი სილიციუმშემცველი კაუჩუკის წარმოებაში. როდიუმის კატალიზატორი აგრეთვე გამოიყენება ბენზოლის ციკლოჰექსანად აღდგენის დროს.
როდიუმის იონის კომპლექსი BINAR-თან (BINAR - არის აბრევიატურა ორგანოფოსფორული ნაერთისა [2.2’ბის(დიფენილფოსფინ)-1.1’-ბინაფთილი]) ფართოდ გამოიყენება ხილარულ კატალიზურ სინთეზში, როგორიცაა, მაგალითად, მენთოლის სინთეზი.
როდიუმმა ასევე ჰპოვა გამოყენება საიუველირო საქმეში სამკაულების მისაღებად. როდიუმით იფარება თეთრი ოქრო და პლატინა, რომელთაც აძლევთ თეთრ პრიალა ზედაპირს. როდიუმი ასევე გამოიყენება ვერცხლის დასაფარავად. იგი ვერცხლს აძლევს გამძლეობას, რათა არ დაიფაროს შავი ლაქებით, რომელიც გამოწვეულია ვერცხლზე ატმოსფერული გოგირდწყალბადის (H2S) მოქმედების შედეგად ვერცხლის სულფიდის (Ag2S) წარმოქმნის გამო. მყარი (სუფთა) როდიუმის სამკაულები საუკეთესოა, რადგანაც მეტალს გააჩნია მაღალი ლღობის ტემპერატურა და იგი ასევე ადვილად ჭედადია (რომელიც სამკაულს ხდის ნამდვილტან ძალიან მიმსგავსებულს) რის გამოც მისი ფასი ძალიან მაღალია.
როდიუმი აგრეთვე გამოიყენება პალადიუმთან და პლატინასთან შენადნობებში, აძლევს რა მათ სიმაგრეს და მდგრადობას კოროზიის მიმართ. ეს შენადნობები გამოიყენება ელექტროღუმელებში, თერმოწყვილებში, ელექტროდებად შიდაწვის ძრავებში ნაპერწკლის დასახშობად და ლაბორატორიული ტიგელების დასამზადებლად. როდიუმი აგრეთვე გამოიყენება ელექტრულ საკონტაქტო მასალად მისი დაბალი ელექტროწინაღობის და მარალი კოროზიამედეგობის გამო.
როდიუმი ასევე გამოიყენება ოპტიკურ ხელსაწყოებში. იგი ფილტრის სახით გამოიყენება მამოგრაფიულ სისტემებში (სისტემაში დამახასიათებელი X-სხივების წარმოქმნის გამო).
როდიუმს ასევე იყენებენ დეტექტორებად ბირთვულ რეაქტორებში ნეიტრონების ნაკადის დნობის გაზომვისას.
უსაფრთხოება
წარმოადგენს რა კეთილშობილ მეტალს, სუფთა როდიუმი ინერტულია, თუმცა როდიუმის ქიმიური კომპლექსები შეიძლება აქტიურიც იყოს. ამჟამად როდიუმ ქლორიდის (RhCl3) ლეტალურო დოზა (LD50) ვირთხებისათვის არის 12.6მგ. ორგანიზმის მასის ყოველ კილოგრამზე. როდიუმის ნაერთებს შეუძლიათ გამოიწვიონ ადამიანის კანის სერიოზული დაზიანება. ადამიანის ორგანიზმში ელემენტს არა აქვს ბიოლოგიური როლი, თუ გამოვიყენებთ მას არა შენაერთების არამედ მისი ელემენტური ფორმით იგი ნაკლებ მავნეა.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


