| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

ნაცრისფერი–მეტალური. ლურჯდება დაჟანვისას
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ნიობიუმი, Nb, 41 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
5, 5, d |
| ატომური მასა |
92.90638 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
Kr] 4d4 5s1 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 12, 1 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
8.57 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
გ სმ-3 |
| ლღობის ტემპერატურა |
2750 K, 2477˚C |
| დუღილის ტემპერატურა |
5017 K, 4744 ˚C, 8571 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
30 კჯ მოლი-1 |
| აორთქლების სითბო |
689.9 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
5, 4, 3, 2, -1 |
| ელექტროუარყოფითობა |
1.6 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 652.1 კჯ·მოლი−1 |
| ატომური რადიუსი |
146 pm |
| კოვანელტური რადიუსი |
164 pm |
| ვან დერ ვაალსის რადიუსი |
pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
კუბური მოცულობითად ცენტრირებული |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 152ნΏ მ |
| სითბოგამტარობა |
(300 K) 53.7 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 7.3 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 3480მ/წმ |
| იუნგის მოდული |
105 გპა |
| შერის მოდული |
38 გპა |
| ბულკის მოდული |
170 გპა |
| სიმტკიცე მოსის მიხედვით |
6.0 |
| CAS-ის რეფისტრაციის ნომერი |
7440-03-1 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 91Nb | სინთ | 6.8×102 y | ε | - | 91Zr |
| 91mNb | სინთ | 60.86 d | IT | 0.104e | 91Nb |
| 92Nb | სინთ | 10.15 d | ε | - | 92 Zr |
| γ | 0.934 | - | |||
| 92Nb | syn | 3.47×107y | ε | - | 92Zr |
| γ | 0.561, 0.934 | - | |||
| 93Nb | 100% | 93Nb სტაბილურია 52 ნეიტრონით | |||
| 93mNb | სინთ | 16.13 y | IT | 0.031e | 93Nb |
| 94Nb | სინთ | 2.03×104 y | β− | 0.471 | 94Mo |
| γ | 0.702, 0.871 | - | |||
| 95Nb | სინთ | 34.991 d | β− | 0.159 | 95Mo |
| γ | 0.765 | - | |||
| 95mNb | სინთ | 3.61 d | IT | 0.235 | 95Nb |
ნიობიუმი
ნიობიუმი ქიმიური ელემენტია (სიმბოლო Nb) ატომური ნომერით 41. იგი მიეკუთვნება იშვიათ, გარდამავალ მეტალებს. ნიობიუმი ნაცრისფერი, რბილი მეტალია. იგი გვხვდება მინერალ პიროქლორში, რომელიც წარმოადგენს ნიობიუმის და კოლუმბიტის ძირითად კომერციულ წყაროს.

ჩარლზ ჰეტჩეტი - კოლუმბიუმის აღმომჩენი
ნიობიუმის ფიზიკური და ქიმიური თვისებები მსგავსია ელემენტ ტანტალისა და ამდენად ერთმანეთისგან ძნელად გასარჩევია. ინგლისელმა ქიმიკოსმა კ.ჰათჩეთმა 1801 წელს პირველად აღნიშნა ტანტალის მსგავსი ქიმიურიელემენტის არსებოა და მას უწოდა კოლუმბიუმი. 1809წ ინგლისელმა ქიმიკოსმა უ.ვოლასტონმა შეცდომით დაასკვნა, რომ ტანტალი და კოლუმბიუმი ინდენტურებია. 1846წ გერმანელმა მეცნიერმა ჰ.როუზმა განსაზღვრა, რომ ტანტალის საბადო შეიცავდა მეორე (სხვა) ელემენტს, რომელსაც მან უწოდა ნიობიუმი. შემდგომმა მეცნიერულმა კვლევებმა უჩვენა, რომ ნიობიუმი და კოლუმბიუმი წარმოადგენდა ერთსა და იმავე ელემენტს (ტანტალისგან განსხვავებულს) და მთელი საუკუნის განმავლობაში ორივე სახელი გამოიყენებოდა მონაცვლეობით. ელემენტის სახელი ნიობიუმი ოფიციალურად დადგინდა 1949 წელს. ნიობიუმს, მე- XX საუკუნის დასაწყისამდე, იყენებდნენ კომერციული მიზნებით. ნიობიუმის და ფერიონოუმის (ნიობიუმისა და რკინის შენადნობი) წარმოებაში მსოფლიოში ბრაზილია ლიდერობს. ელემენტის ძალიან მცირე რაოდენობით შერევაც კი ფოლადს აძლევს მდგრადობას. ნიობიუმის შემცველი ზეშენადნობების ტემპერატურული მდგრადობა საშუალებას იძლევა გამოვიყენოთ იგი სარაკეტო ძრავებში. ნიობიუმი აგრეთვე გამოიყენება ტიტანისა და კალას შემცველ სხვადასხვა ზეგამტარ მასალებში, რომლებიც ფართოდ გამოიყენებიან MRI სკანირების ზეგამტარ მაგნეტებში. ნიობიუმი ასევე გამოიყენება ბირთვულ ინდუსტრიაში, ელექტრონიკაში, ოპტიკაში, ნუმიზმატიკასა და ძვირფასეულობის წარმოებაში.
დახასიათება
ფიზიკური თვისებები
_-_n__2990_-_Niobe_madre_-_Firenze.jpg)
ნიობის ელინური სკულპტურა (ჯიორჯიო სომერი)
ნიობიუმი მბრწყინავი, რუხი ფერის დრეკადი პარამაგნიტური მეტალია, რომელიც პერიოდული სისტემის მეხუთე ჯგუფში მდებარეობს. მას ახასიათებს მაღალი სიმაგრე და ჭედადობა. ჰაერზე მდგრადი და პარამაგნიტურია. გარე ელექტრონულ შრეზე დანარჩენ წევრებთან შედარებით გააჩნია ელექტრონების არატიპიური კონფიგურაცია. (ეს აღინიშნება მის მეზობელ რუთენიუმში, როდიუმში (45) და პალადიუმში (46)).
ნიობიუმი კრიოგენულ ტემპერატურაზე ხდება ზეგამტარი. მას ატმოსფერულ წნევაზე გააჩნია ელემენტური სუპერგამტარობის უმაღლესი კრიტიკული ტემპერატურა- 9.2K. ნიობიუმს, სხვა ელემენტებთან შედარებით, უდიდესი მაგნიტური შეღწევადობა გააჩნია. ნიობიუმის ზეგამტარობა ძლიერ არის დამოკიდებული ამ მეტალის სისუფთავეზე. სუფთა მდგომარეობაში იგი შედარებით რბილი და დრეკადია, მაგრამ მინარევების დროს უფრო მაგრდება. მეტალს გააჩნია ტერმინალური ნეიტრონების დაბალი განივი კვეთის დამჭერი, ამიტომაც იგი გამოიყენება ბირთვულ ინდუსტრიაში.
ქიმიური თვისებები
მეტალი ნიობიუმი ოთახის ტემპერატურაზე, ჰაერზე გარკვეული პერიოდით დაყოვნებისას მოლურჯო შეფერვას ღებულობს. მიუხედავად იმისა, რომ ელემენტურ ფორმაში მას გააჩნია მაღალი ლღობის ტემპერატურა (2468 °C), ახასიათებს დაბალი სიმკვრივე, სხვა ძნელადლღობად მეტალებთან შედარებით. იგი წარმოადგენს კოროზიამედეგ მეტალს, რომელიც ამჟღავნებს ზეგამტარობის უნარს და წარმოქმნის ოქსიდის ფენებს.
ნიობიუმის ელექტროუარყოფითობა ნაკლებია, ვიდრე პერიოდულ სისტემაში მის წინ მდგომი ცირკონიუმისა, მაშინ როცა იგი ზომაში ვირტუალურად იდენტურია უფრო მძიმე ტანტალისა. ამიტომაც, ნიობიუმის ქიმიური თვისებები ძალიან ემსგავსება ტანტალისას, რომელიც პერიოდულ სისტემაში განლაგებულია ნიობიუმის ქვემოთ. მიუხედავად იმისა, რომ მისი კოროზიული მედეგობა არ არის ისეთივე გამოკვეთილი, როგორიც ტიტანის, მაგრამ დაბალი ფასისა და დიდი მისაწვდომობის გამო, ნიობიუმი ხდება უფრო ხელმისაწვდომი დანადგარების მოსაპირკეთებლად.
იზოტოპები
ბუნებაში, ნიობიუმი გვხვდება ერთადერთი სტაბილური იზოტოპის 93Nb–ის სახით. 2003წ სინთეზირებულ იქნა 32–მდე რადიოიზოტოპი, რომელთა ატომური მასები 81-დან 113–მდე მერყეობს. მათგან ყველაზე სტაბილურია 92Nb (ნახევარდაშლის პერიოდით 34.7 მილიონი წელი). ყველაზე ნაკლებ სტაბილურია 113Nb (ნახევარდაშლის პერიოდი – 30მილიწამი).
აღწერილია 25 ბირთვული იზომერი, ატომური მასით 84–დან 104–მდე. ამ რიგში იზომერი არ აქვს მხოლოდ 96Nb, 101Nb და 103Nb–ს. ნიობიუმის იზომერიდან ყველაზე მდგრადია 93მეტაNb (ნახევარდაშლის პერიოდი 103ნწმ). გარდა 92მეტაNb–ისა, ნიობიუმის ყველა იზომერი იშლება ან იზომეტრიული გარდაქმნით ან ბეტა–დაშლით.
გავრცელება
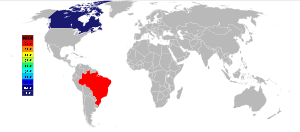
ნიობიუმი 33–ე ელემენტს წარმოადგენს დედამიწაზე გავრცელების მიხედვით. ბუნებაში თავისუფალი ელემენტი არ არის ნაპოვნი, მაგრამ იგი გვხვდება მინერალებში. მინერალებში ნიობიუმი და ტანტალი თითქმის ყოვრლთვის ერთად არიან. ასეთია მაგალითად, კოლუმბიტი ((Fe,Mn)(Nb,Ta)2O6 და კოლუმბიტ–ტანტალიტი (ან კოლტანი (FeMn)(TaNb)2O6. ნაკლებ გავრცელებულია კალციუმის, თორიუმის და იშვიათ მიწათა ელემენტების ნიობატები და იშვიათმიწათა ელემენტების სახით, როგორიცაა, პიროქლორი ((Na,Ca)2Nb2O6-(OH,F)).
პიროქლორის ორი უდიდესი დეპოზიტი 1950წ იქნა აღმოჩენილი ბრაზილიაში და კანადაში, ორივე ეს ქვეყანა დღემდე რჩება ნიობიუმის მინერალების კონცენტრაციების მთავარ მწარმოებლად. ბრაზილიაში ნიობიუმს აწარმოებს ორი კორპორაცია. ნიობიუმზე მსოფლიო მოთხოვნაა 77%. ნიობიუმის მესამე უდიდესი მწარმოებელია „Lamgold Corporation Ltd” კანადაში, რომელიც აწარმოებს ნიობიუმის მსოფლიო მოთხოვნის 7%–ს.
დაუმუშავებელი რესურსები განლაგებულია ნიგერიაში, კონგოს დემოკრატიულ რესპიბლიკაში, ტანზანიაში, მალაზიაში, ავსტრალიაში, რუსეთში და კოლუმბიაში.
წარმოება
ნიობიუმის წარმოება
სხვადასხვა მინერალებისგან იქნა გამოყოფილი ნიობიუმის (Nb2O5) და ტანტალის (Ta2O5) ოქსიდების ნარევი. პროცესში პირველი რეაქცია, რომელიც ხორციელდება ოქსიდებზე, ესაა მათი ურთიერთქმედება ფტორწყალბადმჟავასთან:
Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
Nb2O5 + 10 HF → 2 H2[NbOF5] + 3 H2O
დაყოფის მეთოდი, რომელიც განავითარა დე მარინგნიმ, ეყრდნობა ნიობიუმისა და ტანტალის კომპლექსური ფტორიდების- დიკალიუმოქსიპენტაფტორნიობატმონოჰიდრიტის (K2[NbOF5]•H2O) და დიკალიუმჰეფტაავტორტანტალის (K2[TaF7])–ის წყალში განსხვავებულ ხსნადობას. პროცესში იყენებენ ფტორიდების ექსტრაქციას წყალხსნარებიდან, ციკლოჰექსანონის მსგავსი ორგანული გამხსნელებით. ნიობიუმის და ტანტალის ფტორიდების კომპლექსს ექსტრაგირებენ ცალ-ცალკე ორგანული გამხსნელებიდან წყლით და ლექავენ კალიუმის ფტორიდის დამატებით. ამ დროს წარმოიქმნება კალიუმფტორიდის კომპლექსი, ან ლექავენ ამიაკით პენტოქსიდის სახით:
H2[NbOF5] + 2 KF → K2[NbOF5]↓ + 2 HF
შემდგომ:
2 H2[NbOF5] + 10 NH4OH → Nb2O5↓ + 10 NH4F + 7 H2O
მეტალური ნიობიუმის აღსადგენად გამოიყენება სხვადასხვა მეთოდი. ერთ–ერთია, გალღობილი K2[NbOF5]–ისა და ნატრიუმის ქლორიდის ნარევის ელექტროლიზი. ასევე იყენებენ ფტორიდების ნატრიუმით აღდგენის რეაქციას. ამ დროს მიიღება, მაღალი რეაქციისუნარიანი, სუფთა ნიობიუმი. ფართოდ იყენებენ, აგრეთვე Nb2O5–ის წყალბადით ან ნახშირბადით აღდგენის რეაქციას. პროცესში იყენებენ ალუმინოთერმიას- რკინის და ნიობიუმის ოქსიდების ურთიერთქმედებას ალუმინთან
3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al2O3
აშშ–ს გეოლოგიური მიმოხილვა იუწყება, მსოფლიო რესურსი შეადგენს 4.400 000 ტონას. ათი წლის განმავლობაში (1995–დან 2005–წ–მდე) ნიობიუმის წარმოება გაორმაგდა.
ნაერთები
ნიობიუმი ბევრი რამით ემსგავსება ტანტალს და ცირკონიუმს. იგი ურთიერთქმედებს არამეტალების უმეტესობასთან მაღალ ტემპერატურაზე. ნიობიუმი ურთიერთქმედებს ფტორთან ოთახის ტემპერატურაზე, ხოლო აზოტთან ურთიერთქმედებს 4000C ტემპერატურაზე. ხშირად იძლევა შუალედურ პროდუქტებს რომლებიც არასტექიომეტრულია. მეტალი ჰაერზე ჟანგვას იწყებს 2000C ტემპერატურაზე და მდგრადია ტუტეებისა და მჟავების, ასევე სამეფო წყლის, ქლორწყალბადმჟავას, გოგირდმჟავას, აზოტ და ფტორმჟავების მოქმედების მიმართ. იგი ურთიერთქმედებს ფტორწყალბადმჟავასთან და ფტორწყალბადმჟავა/აზოტმჟავას ნარევთან.
ნიობიუმს ახასიათებს –1–დან +5–მდე დაჟანგულობის ხარისხი, ყველაზე მეტად გავრცელებულია ნაერთები, სადაც იგი ამჟღავნებს +5 დაჟანგულობის ხარისხს. დამახასიათებელია, ნაერთები Nb-Nb ბმით, რომელშიც მისი დაჟნგულობის ხარისხი +5–ზე ნაკლებია.
ოქსიდები და სულფიდები
ნიობიუმი წარმოქმნის ოქსიდებს დაჟანგულობის რიცხვით: +5 (Nb2O5), +4 (NbO2), და +3 (Nb2O3), ამასთან იშვიათად გვხვდება დაჟანგულობის რიცხვი +2 (NbO)41. გვხვდება აგრეთვე პენტოქსიდი, რომელიც წარმოადგენს ნიობიუმის თითქმის ყველა ნაერთსა და შენადნობის პრეკურსორს. ნიობატები მიიღება პენტოქსიდების გახსნით ფუძეებში ან ტუტე მეტალების ოქსიდებთან შელღობით. მაგალითად, ლითიუმის ნიობატი (LiNbO3) და ლანთანიუმ ნიობატი (LaNbO4). ლითიუმის ნიობატს აქვს გამრუდებული ტრიგონალური სტრუქტურა, მაშინ როცა ლანთან ნიობატი შეიცავს NbO43− იონს. აგრეთვე ცნობილია ნიობიუმის სულფიდი (NbS2)
ჰალოგენიდები

ნიობიუმის პენტაქლორიდის (ყვითელი) კრისტალები. თეთრი კრისტალები მიუთითებს ნაწილობრივ ჰიდროლიზს.
ნიობიუმი წარმოქმნის ჰალოგენიდებს დაჟანგულობის ხარისხით +5 და +4. ჰენტაჰალოგენიდები (NbX5) წარმოადგენენ ოქტაედრს, რომლის ცენტრშიც არის ნიობიუმი. ნიობიუმ პენტაფტორიდი (NbF5) წარმოადგენს თეთრ, მყარ ნივთიერებას, ლღობის ტემპერატურით 79,0°C, ნიობიუმ პენტაქლორიდი (NbCl5) კი არის ყვითელი ფერის ნივთიერება ლღობის ტემპერატურით 203.4°C. ორივე ნივთიერება განიცდის ჰიდროლიზს და იძლევა ოქსიდებს და ოქსიდჰალოგენებს, როგორიცაა მაგალითად NbOCl3. პენტაქლორიდი გამოიყენება ძირითადად ორგანომეტალური ნაერთების მისაღებად, როგორიცაა ((C5H5)2NbCl2). ტეტრაჰალოგენიდი (NbX4) მუქი ფერის პოლიმერი Nb-Nb ბმით, მაგალითად, შავი ჰიგროსკოპული ნიობიუმტეტრაქლორიდი (NbF4) და ყავისფერი ნიობიუმტეტრაქლორიდი (NbCl4). კარგადაა ცნობილი ნიობიუმის ანიონური ჰალოგენიდები. მათ შორისაა პენტაჰალოგენიდები. მნიშვნელოვანია [NbF7]2-, რომელიც შუალედური პროდუქტია საბადოებიდან Nb და Ta გამოყოფის დროს. ეს ჰეფტაფტორიდი წარმოქმნის ოქსოპენტაქლორიდს უფრო ადვილად, ვიდრე ტანტალის ნაერთები. სხვა ჰალოგენიდკომპლექსები მოიცავენ ოქტაედრს [NbCl6]-:
Nb2Cl10 + 2 Cl- → 2 [NbCl6]-
ნიტრიდები და კარბიდები

მთვარის ორბიტის Apollo 15 CSM თანამგზავრი დამზადებულია ნიობიუმ-ტიტანის შენადნობით
ნიობიუმის ბინარულ ნაერთს წარმოადგენს აგრეთვე ნიობიუმის ნიტრიდი (NbN), რომელიც დაბალ ტემპერატურაზე ხდება ზეგამტარი და გამოიყენება ინფრაწითელი სხივების დეტექტორად. ნიობიუმის კარბიდი NbC წარმოადგენს მაგარ, ცეცხლგამძლე კერამიკულ მასალას, რომელიც გამოიყენება სტომატოლოგიაში.
გამოყენება
2006 წელს ნიობიუმის 44.500 მეტრი ტონა იქნა წარმოებული, რომლის 90% გამოყენებული იქნა მაღალი ხარისხის ფოლადის წარმოებაში, იგი აგრეთვე გამოყენებული იქნა ზეშენადნობებში. ნიობიუმი ასევე იხმარება თვითმფრინავმშენებლობისთვის საჭირო ნიობიუმიანი და ქრომ–ნიკელიანი (უჟანგავი) ფოლადის წარმოებაში. მისი კარბიდი (NbC) ტანტალის ან ვოლფრამის კარბიდთან ერთად, გამოყენებას პოულობს სალი, მჭრელი შენადნობების დასამზადებლად. ნიკელის ბაზაზე მიღებული, ნიობიუმშემცველი სუპერშენადნობი სინკონელ - 718, რომელიც შეიცავს 50% ნიკელს, 18.6% ქრომს, 18.5% რკინას, 5% ნიობიუმს, 3.1% მოლიბდენს, 0.9% ტიტანს და 0.4% ალუმინს. გამოიყენება საჰაერო სისტემაში.
შენადნობი რომელიც გამოიყენება სარაკეტო სისტემაში. მაგალითად, “Apollo” მოდულში – C103, შეიცავს 89% ნიობიუმს, 10% ჰაფნიუმს და 1% ტიტანს.
გამოყენება ელექტროტექნიკაში
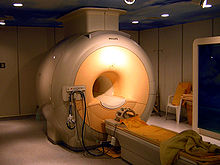
3 ტესლა სიმძლავრის სამედიცინო მაგნიტური რეზონანსის აპარატში გამოყენებულია ნიობიუმის ზეგამტარი შენადნობი
ლითიუმის ნიობატი, რომელიც ფეროელექტრულია, ინტენსიურად გამოიყენება მობილურ ტელეფონებსა და ოპტიკურ მოდულატორებში. ნიობიუმი ემატება მინას და ანიჭებს მას მაღალ რეფრაქციულ ინდექსს, რის შედეგადაც შესაძლებელი ხდება მისი გამოყენება ოპტიკურ ინდუსტრიაში.
მედიცინა და სამკაულები
ნიობიუმი და ზოგიერთი მისი შენადნობი ფიზიოლოგიურად ინერტულია და ამდენად ჰიპოალერგეტიკულია. ამის გამო ნიობიუმი გამოიყენება ბევრ სამედიცინო ჩანადგარებში და სამკაულების წარმოებაშიც. ნატრიუმის ჰიდროქსიდით დამუშავებისას წარმოქმნის ფოროვან შრეს, რომელიც გამოიყენება ოსეოინტეგრაციაში. ტიტანთან წყალთან და ალუმინთან ერთად, ნიობიუმს შეუძლია ელექტრულად გაცხელდეს და ანოდიზირდეს – ეს თვისება გამოიყენება სამკაულების წარმოებაში.
ნუმიზმატიკა
ნიობიუმი გამოიყენება მემორიალურ მონეტებში, როგორც ძვირფასი მეტალი, ხშირად ვერცხლთან და ოქროსთან ერთად. მაგალითად, ავსტრია, 2003წ–დან აწარმოებს ვერცხლი–ნიობიუმის ევრო მონეტების სერიას. ამ მონეტებში ფერი იქმნება ანოდიზირების შედეგად წარმოქმნილი თხელი ოქსიდის ფენის სინათლის დიფრაქციით. 2008 წელს ექვსი მონეტა უჩვენებდა ფერთა ფართო სპექტრს მონეტის შიგნით: ლურჯი, მწვანე, ყავისფერი, მეწამული, იისფერი და ყვითელი ფერები. 2004 წელს ლატვიაც აწარმოებდა მონეტების მსგავს სერიას, რომელიც გაგრძელდა 2007წელსაც
სიფრთხილე
არ არის ცნობილი ნიობიუმის ბიოლოგიური როლი, მაგრამ მისი მტვერი იწვევს თვალების და კანის გაღიზიანებას და პოტენციურად საშიშია. ნიობიუმის ზოგიერთი ნაერთი ტოქსიკურია და მასთან მუშაობისას საჭიროა სიფრთხილის გამოჩენა. ნიობატები და ნიობიუმ ქლორიდი, რომლებიც წყალში ხსნადი ნაერთებია, გამოსცადეს ვირთხებზე. ნაჩვენები იქნა, რომ ლეტალური დოზაა(LD50) 10-დან 100მგ/კგ, რაც გაცილებით ნაკლებია თუ მას გამოიყენებენ აბების სახით.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


