| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

მტკიცე პრიალა ნაცრისფერი მეტალი
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
კობალტი, Co, 27 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
9, 4, d |
| ატომური მასა |
58.933195(5) გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Ar] 4s2 3d7 |
| ელექტრონები ორბიტალებზე |
2, 8, 15, 2 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი (მეტალური ნაცრისფერი) |
| სიმკვრივე |
8.90 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
7.75 გ სმ-3 |
| ლღობის ტემპერატურა |
1768 K, 1495˚C |
| დუღილის ტემპერატურა |
3200 K, 2927 ˚C, 5301 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
16.06 კჯ მოლი-1 |
| აორთქლების სითბო |
377 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
5, 4 , 3, 2, 1, -1 |
| ელექტროუარყოფითობა |
1.88 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 760.4 კჯმოლი-1 |
| ატომური რადიუსი |
125 pm |
| კოვანელტური რადიუსი |
[126±3] pm |
| ვან დერ ვაალსის რადიუსი |
___pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური |
| მაგნიტური მოწესრიგებულობა |
ფერომაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 62.4ნΏ მ |
| სითბოგამტარობა |
(300 K) 100 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 13.0 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 4720 მ/წმ |
| იუნგის მოდული |
209 გპა |
| შერის მოდული |
75 გპა |
| ბულკის მოდული |
180 გპა |
| სიმტკიცე მოსის მიხედვით |
5.0 |
| CAS-ის რეფისტრაციის ნომერი |
7440-48-4 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 56Co | სინთეზ | 77.27 d | ε | 4.566 | 56Fe |
| 57Co | სინთეზ | 271.79 d | ε | 0.836 | 57Fe |
| 58Co | სინთეზ | 70.86 d | ε | 2.307 | 58 Fe |
| 59Co | 100% | 59Co მდგრადია 32 ნეიტრონით | |||
| 60Co | სინთეზ | 5.2714 წელი | β− , γ , γ | 2.824 | 60 Ni |
კობალტი
კობალტი წარმოადგენს მაგარ, მბრცყინავ, რუხი ფერის მეტალს. მისი სიმბოლოა Co, ატომური ნომერი 27. კობალტის საფუძველზე მიღებული ფერები და პიგმენტები უძველესი დროიდან გამოიყენება ძვირფას ქვებში, საიუველიერო ნაწარმებსა და მხატვრობაში.
კობალტი გვხვდება სხვადასხვა, მეტალური ბზინვარების საბადოებში, მაგალითად კობალტინი (CoAsS), მაგრამ იგი ძირითადად მიიღება როგორც სპილენძისა და ნიკელის თანამდევი პროდუქტი. კონგოს დემოკრატიულ რესპუბლიკაში და ზამბიაში კობალტს ღებულობენ დიდი რაოდენობით.
კობალტი გამოიყენება მაგნიტური მდგრადი და გამძლე შენადნობების მისაღებად. სმალიტები (კობალტ სილიკატური მინა) და კობალტის ლურჯი (კობალტ (II) ალუმინიტი, CoAl2O¬4) მინებს აძლევენ მკვეთრ, ღრმა ლურჯ შეფერვას, ასევე კერამიკას,მელანს, საღებრებს და ლაქებს.
კობალტი არის აუცილებელი ელემენტი ცხოველტა ორგანიზმისათვის, როგორც კობალტმინკოენზიმის აქტიური ცენტრი. იგი შეიცავს ვიტამინ B12, რომელიც აუცილებელია ძუძჲმწოვრებისათვის. კობალტი აგრეთვე წარმოადგენს ბაქტერიების და სოკოების აქტიურ მკვებავს.
ფიზიკური თვისებები

ელექტროქიმურად მიღებული 99.9% სისუფთავის კობალტი
კობალტი ფერომაგნიტური მეტალია სპეციფიური მიზიდულობით 8.9 (20°C). იგი წარმოადგენს მკრთალი ყვითელი ფერის მეტალს ვარდისფერი ან ლურჯი ელფერით. ბუნებაში სუფთა კობალტი არ არის ნაპოვნი, მაგრამ მისი ნარტბი საკმაოდ გავრცელებულია.იგი მცირე რაოდენობით ნაპოვნია საბადოებში, მტვერში, მცენარეებსა და ცხოველებში. მისი ატომური ნომერია 27. კიურის ტემპერატურაა 1115°C, ხოლო მაგნიტური მომენტია 1.6-1.7. ბუნებაში იგი სწრაფად უკავშირდება ნიკელს და ორივე წარმოადგენს მეტეორული რკინის დამახასიათებელ კომპონენტს. ძუძუმწოვრებს ესაჭიროება კობალტის მცირე რაოდენობა, რომელსაც ისინი ღებულობენ ვიტამინ B12-ის ბაზაზე. კობალტ-60 წარმოადგენს კობალტის ხელოვნურ რადიოაქტიურ იზოტოპს, იგი არის მნიშვნელოვანი რადიოაქტიური თრეისერი და გამოიყენება როგორც ანტიკანცეროგენური აგენტი. 60Co იზოტოპი მედიცინაში და ტექნიკაში აგრეთვე გამოიყენება, როგორც g-გამოსხივების წყარო.
ქიმიური თვისებები
კობალტი სუსტი აღმდგენი მეტალია. იგი დაჟანგვისას იფარება პასიური ოქსიდის ფენით, რომელიც ასე დამახასიათებელია უმეტესი მეტალებისათვის. იგი ურთიერტქმედებს ჰალოგენებთან და გოგირდტან. ჟანგბადში გაცხელებით იძლევა Co3O4, რომელიც 900°C-ზე კარგავს ჟანგბადს და გადადის მონოქსიდში CoO.
კობალტის ჟანგვითი რიცხვია +2 და +3, თუმცა ცნობილია ნაერთები ჟანგვითი რიცხვით -3-დან +4-ის ჩათვლით. კობალტ (II) მარილები წყალხსნარებში წარმოქმნიან მოვარდისფრო-წითელ კომპლექსს [Co(H2O)6]+2. ქლორიდის დამატება იძლევა ინტენსიური ლურჯი ფერის კომპლექსს [CoCl4]-2.
იზოტოპები
59Co წარმოადგენს კობალტის ერთადერთ სტაბილურ იზოტოპს და ასევე ერთადერთ იზოტოპს, რომელიც ბუნებაში არსებობს. დახასიათებულია კობალტის 22 რადიოიზოტოპი, რომელთაგან ყველაზე სტაბილურია 60Co - ნახევარდაშლის პერიოდით 5.2714 წელი, 57Co - ნახევარდაშლის პერიოდით 271.79 დღე, 56Co - ნახევარდაშლის პერიოდით 77.27დღე და 58Co - ნახევარდაშლის პერიოდით 70.86 დღე.ყველა დანარჩენი რადიოიზოტოპის ნახევარდაშლის პერიოდი 18 საათზე ნაკლებია, მათგან უმეტესობის ნახევარდაშლის პერიოდი 1 წმ-ზე ნაკლებია. ამ ელემენტს აგრეთვე აქვს ოთხი მეტა მდებარეობა, მათი ნახევარდაშლის პერიოდი 15 წუთზე ნაკლებია.
გავრცელება
კობალტის მდგრადი ფორმა წარმოიქმნება უახლოეს ვარსკვლავ ასტრონზე r-პროცესების გავლით. კობალტი დედამიწის ქერქის 0.0029% შეადგენს და იგი წარმოადგენს გარდამავალი სერიის მეტალს.
კობალტი გვხვდება სპილენძისა და ნიკელის მინერალებში და აგრეთვე ხშირად გვხვდება გოგირდთან და დარიშხანთან ერთად კომბინაციაში. იგი გვხვდება მინერალებში: კობალტინი (CoAsS), საფლორიტი (CoAs2), სკუთერედიტი (CoAs3) და გლაუკოდიტი. მინერალი კათერიტი მსგავსია პირიტის და გვხვდება სპილენძის დეპოზიტში. ატმოსფეროში სულფიდური მინერალები იჯანგებიან და გადადიან ვარდისფერ ერითრიტში (”კობალტის კრიალა”: Co3(AsO4)2•8H2O) და სფეროკობალტიტი (CoCO3).
მიღება

კობალტის წიაღისეული
2005 წელს კატანგის პროვინციაში (კონგოს დემოკრატიული რესპუბლიკა), სპილენძის დეპოზიტის დამუშავებით ღებულობდნენ კობალტს, რომელიც შედგენდა მსოფლიო წარმოების დაახლოებით 40%.
სპილენძისა და ნიკელისაგან კობალტის გამოყენების რამოდენიმე მეთოდი არსებობს, რაც დამოკიდებულია გამოყენებული საბადოს შემადგენლობაზე და კობალტის კონცენტრაციაზე. საბადოში კობალტის გამოყოფის ერთ-ერთი საფეხური მოიცავს ქაფის ფლოტაციას, რომელშიც ხდება, სხვადასხვა მადნის კომპონენტების დაკავშირება, რასაც მივყავართ კობალტის მადნის გამდიდრებამდე. შემდგომი გაცხელებით საბადო გადადის კობალტის სულფიდში, მაშინ როცა სპილენძი და რკინა იჟანგება ოქსიდამდე. შემდგომ ახდენენ წყალხსნარის ექსტრაქტიდან სულფატის და არსენატის ერთად გამოტუტვას. ნალექს ამუსავებენ გოგირდმჟავით და იღებენ სპილენძის სულფატის ხსნარს. კობალტი ასევე შეიძლება მიღებულ იქნას სპილენძის ნალღობის შლაკების გამოტუტვით.
ზემოთ აღნიშნული პროცესის დროს პროდუქტები გარდაიქმნებიან კობალტის ოქსიდად (Co3O4), რომელსაც შემდეგ აღადგენენ ალუმინოთერნიით ან აღადგენენ ნახშირით ბრძმედებში.
კობალტის ნაერთები
ჟანგბად და ქალკოგენ ნაერთები
ცნობილია კობალტის რამოდენიმე ოქსიდი. მწვანე კობალტ(II) ოქსიდს (CoO) აქვს ქვამარილის სტრუქტურა. იგი ადვილად იჟანგება წყალტან და ჟანგბადთან და იძლევა კობალტ(III) ჰიდროქსიდს - (CoO(OH)). 600–700 °C ტემპერატურაზე CoO იჟანგება ლურჯი ფერის კობალტ (II, III) ოქსიდამდე (Co3O4), რომელსაც ფერომაგნიტური რკინის სტრუქტურა აქვს. აგრეთვე ცნობილია სავი კობალტ(III) ოქსიდი (Co2O3). კობალტის ოქსიდები არიან ანტიფერომაგნიტურები დაბალ ტემპერატურაზე: CoO (ნეელის ტემპერატურა 291 K) და Co3O4 (ნეელის ტემპერატურა 40 K), სადაც იგი მაგნეტიტის (Fe3O4) ანალოგიურია, რომელშიც კობალტის ჟანგვითი რიცხვი +2 და +3 ერთად.
.png)
კობალტის მოპოვება 2005 წელს
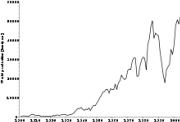
კობალტის წარმოება მსოფლიო მასშტაბით
კობალტის ქალკოგენიდებია შავი კობალტ(II) სულფიდი CoS2, რომელსაც პირიტის მსგავსი სტრუქტურა აქვს და Co2S3. პენტლენდიტი (Co9S8) არის მეტალით მდიდარი ნაერთი.
ჰალოგენიდები
-chloride-hexahydrate-sample.jpg)
კობალტ (II) ქლორიდის ჰექსაჰიდრატი
ცნობილია კობალტის ოთხი დიჰალოგენიდი: კობალტ(II) ფტორიდი (CoF2, ვარდისფერი), კობალტ(II) ქლორიდი (CoCl2, ლურჯი), კობალტ(II) ბრომიდი (CoBr2, მწვანე), კობალტ(II) იოდიდი (CoI2, მუქი ლურჯი). ეს დიქლორიდები არსებობენ, როგორც უწყლო , ისე ჰიდრატების სახით, ამასტან უწყლო დიქლორიდები ლურჯი ფერისაა, ხოლო ჰიდრატები წითელი. კობალტ(III)-ის მცირერიცხოვან მდგრად მარტივ ნაერთებს შორის ერთ-ერთია კობალტ(III) ფტორიდი. იგი გამოიყენება ფტორირების ზოგიერთ რეაქციაში, წყალტან რეაგირებს მძაფრად.
კოორდინაციული ნაერთები
კოორდინაციული ნაერთები როგრც ყველა მეტალისთვისაა დამახასიათებელი, ასევე კობალტის მოლეკულური ნაერთები კლასიფიცირდებიან, როგორც კოორდინაციული კომპლექსები, ანუ კობალტის შემცველი მოლეკულები ან იონები ერთიანდებიან სხვადასხვა ლიგანდებად, რომელიც განსაზღვრავს ჟანგვით რიცხვს. მაგალითად, Co+3კომპლექსებს აქვთ მიდრეკილება წარმოქმნან ამინის ლიგანდი. ფოსფინის ლიგანდი ცდილობს დაიკავშიროს Co+2 და Co+. ამის მაგალითს წარმოადგენს ტრის(ტრიფენილფოსფინ) კობალტ(I)-ის ქლორიდი ((P(C6H5)3)3CoCl). ოქსიდსა და ქლორიდს შეუძლიათ Co4+ წარმოებულების სტაბილიზირება, მაგალითად კოენზიმი ჰექსაქლორკობალტატი (Cs2CoF6)) და კალიუმის პერკობალტატი (K3CoO4).
ალფრედ ვერნერი, ნობელის პრემიის გამარჯვებული კოორდინაციულ ქიმიაში მუშაობდა ნაერთებზე, ემპირიული ფორმულით CoCl3(NH3)6. განსაზღვრული იქნა კობალტ(III) ჰექსამინქლორიდის ერთ-ერთი იზომერი. ეს კოორდინაციული კომპლექსი ”ტიპიური” ვერნერის ტიპის კომპლექსია. იგი შეიცავს ექვსი ამინის ლიგანდის მიერ კოორდინაციულ ცენტრალურ კობალტის ატომს, რომლებიც ერთმანეთის მიმართ განლაგებულნი არიან ორთოგონალურად, სადაც მოპირდაპირედ განლაგებულია სამი ქლორიდ ანიონი.
მეტალორგანული ნაერთები. კობალტოცენი წარმოადგენს ფეროცენის მდგრად ანალოგს. კობალტკარბონილი (Co2(CO)8) წარმოადგენს კარბონილირების რეაქციის კატალიზატორს. ვიტამინი B12 არის იშვიათი მეტალოორგანული ნაერთი, რომელიც ნაპოვნია ბუნებაში. იგი ერთადერთი ვიტამინია, რომელიც შეიცავს მეტალის ატომს.
ისტორია
კობალტის შენაერთებს საუკუნეების განმავლობაში იყენებდნენ მუქილურჯი შეფერილობის მისაცემად მინების, ჭიქურების და კერამიკისათვის. კობალტი ჩვენს ერამდე სამი ათასი წლის წინ იქნა აღმოჩენილი ეგვიპტეში და სპარსეთში, ასევე ჩინეთში.
კობალტი პირველად აღმოაჩინა შვედმა ქიმიკოსმა გ. ბრანდტმა 1735 წელს. მან შეძლო ეჩვენებინა, რომ მინის ლურჯი შეფერვა გამოწვეული იყო კობალტის არსებობით. (ადრე თვლიდნენ, რომ ეს იყო გამოწვეული ბისმუტით) სიტყვა კობალტი წარმოდგა გერმანული სიტყვისაგან ”kobalt”. ”kobold” ნიშნავს "goblin"-ს (ფუძის, სახლის ანგელოზს), მე-19 საუკუნეში კობალტს დიდი რაოდენობით აწარმოებდნენ ნორვეგიაში (მსოფლიო წარმოების 70-80%).
გამოყენება

ადრეული ხანის ჩინური ლურჯი და თეთრი ფაიფურის ნაკეთობა, დამზადებული 1335 წელს
კობალტი, როგორც მეტალი ძირითადად გამოიყენება შენადნობების სახით. მათგან ამზადებენ ცეცხლგამძლე მასალებს, გაზის ტურბინებს და საავიაციო-საინჟინრო მასალებს. ერთ-ერთი ასეთი შენადნობია ვიტალუმი (65% Co, 28% Cr, 3% W და 4% Mo), რომელიც არ განიცდის კოროზიას 800-850 °C-მდე. მყარი შენადნობები - სტელიტები (40-60% Co, 20-35% Cr, 5% W და 1-2% C) გამოიყენება მჭრელი ინსტრუმენტების დასამზადებლად. როგორც უჟანგავ ლითონს, კობალტს იყენებენ ფოლადისა და რკინის ნაკეთობების დასაფარავად (მოკობალტება). კობალტი ასევე შედის კერამიკომეტალური, მყარი შენალღობების შემადგენლობაში (კერმეტები). კობალტის ნაერთები მინას აძლევენ მუქ ლურჯ შეფერვას (კობალტის სილიკატის წარმოქმნის გამო). ასეთი მინები დანაყული ფხვნილის სახით გამოიყენება ”სმალტების” ან ”კობალტას” სახელით ლურჯ საღებრებში. ”სმალტები” წარმოადგენს მინერალ სმალტიტის კვარცისა და კალიუმის კარბინატის ნალღობის ნარევს, რომელიც სილიკატურ მინას აძლევს მუქ ლურჯ შეფერვას. შუა საუკუნეებში (1780, 1802) აღმოჩენილი იქნა კობალტ-მწვანე და კობალტ-ლურჯი. ეს ორი ფერი - კობალტ-ლურჯი (კობალტის ალუმინატი) და კობალტ-მწვანე (კობალტ(II) ოქსიდისა და თუთიის ოქსიდის ნარევი) გამოიყენებოდა როგორც პიგმენტები.
კობალტის შენადნობები, როგორც ზემოთ ავღნიშნეთ მდგრადია კოროზიის მიმართ. სპეციალური კობალტ-ქრომ-მოლიბდენის შენალღობი გამოიყენება თეძოსა და მუხლის პროტეზირებაში, აგრეთვე გამოიყენება კბილის პროტეზებში (ნიკელის მიმართ ალერგიის თავიდან აცილების მიზნით). ზოგიერთი ხარისხის ფოლადში კობალტს ამატებენ ტემპერატურისა და ატმოსფეროს მიმართ გამძლეობის გასაზრდელად. ალუმინის, ნიკელის, კობალტის და რკინის სპეციალური შენადნობი (ცნობილი ალნიკოს სახელწოდებით) და სამარიუმი და კობალტი (სამარიუმ-კობალტის მაგნეტი) გამოიყენებიან მუდმივ მაგნეტებში.
ლითიუმ-კობალტ ოქსიდი (LiCoO2) ფართოდ გამოიყენება ლითიუმ იონის შემცველი ბატარეების ელექტროდებში. ნიკელ-კადმიუმი (NiCd) და ნიკელ-მეტალჰიდრიდი (NiMH) ბატარეები აგრეთვე მნიშვნელოვნად შეიცავენ კობალტს.
კობალტის სხვადასხვა ნაერთებმა გამოყენება ჰპოვა კატალიზური ჟანგვის რეაქციებში. კობალტის აცეტატი იხმარება ქსილოლის ტერეფტალმჟავად გარდაქმნის დროს, რომელიც წარმოადგენს პრეკურსორს პოლიეთილენტერეფტის პოლიმერის მისაღებად. კობალტის კარბოქსილატები წარმოადგენენ ტიპიურ კატალიზატორებს (ცნობილია კობალტის საპნების სახელწოდებით). ისინი აგრეთვე გამოიყენებიან ლაქებში და მელნებში, როგორც ”მშრალი აგენტები” მშრალი ზეთების დაჯანგვისას. იგივე კარბოქსილატები გამოიყენება ფოლადის ადგეზიური თვისებების გასაუმჯობესებლად. კობალტის ბაზაზე არსებულ კატალიზატორებს აგრეთვე დიდი მნიშვნელობა აქვთ ნახშირბადის მონოქსიდისათვის დამახასიათებელ რეაქციებში. კობალტი გამოიყენება ფიშერ-ტროპშის რეაქციებში კატალიზატორად. კერძოდ გამოიყენება ნახშირბადის მონოქსიდის ჰიდროგენიზაციის რეაქციებში, სადაც ეს უკანასკნელი გარდაიქმნება თხევად საწვავად. ალკანების ჰიდროფორმილირების დროს ხშირად კატალიზატორად იყენებენ კობალტის ოქტაკარბონილს.
ბენზინის ჰიდროდესულფირების პროცესში კატალიზატორად გამოიყენება კობალტისა და მოლიბდენის ნაწარმები. ეს პროცესი ხელს უწყობს ბენზინის გასუფთავებას გოგირდის მინარევებისაგან, რომელიც წარმოადგენს ხელის შემშლელ ფაქტორს თხევადი საწვავის გასუფთავების დროს.
სიფრთხილე
კობალტი მცირე რაოდენობით წარმოადგენს ცოცხალი ორგანიზმისათვის აუცილებელ ელემენტს. კობალტის ხსნადი მარილებისათვის LD50-ს წარმოადგენს 150-დან 500მგ/კგ. მაგალითად, 100კგ. წონის ადამიანის LD50 შეადგენს დაახლოებით 20 გრამს.
1966 წელს, კანადაში, ლუდის ქაფის სტაბილიზაციისათვის დაამატეს კობალტის ნაერთები, რამაც გამოიწვია კარდიომიოპატია, რომელიც ამის შემდეგ ცნიბილია როგორც ”ლუდის მსმელების კარდიომიოპატია ”.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


